
Pengertian Reaksi Redoks, Penyetaraan, Fungsi dan Contoh Soal
Pengertian Reaksi Redoks, Penyetaraan, Fungsi dan Contoh Soal. Pembahasan materi reaksi redoksi yang meliputi definisi, penyetaran reaksi redoks, fungsi, serta contoh soal tentang reaksi redoks yang dapat sobat jawab untuk melatih apakah sobat sudah paham materi pelajaran reaksi redoks apa belum.
Sebelumnya juga telah kami sajikan materi pelajaran fisika tentang perbedaan zat padat, dengan zat cair, dan zat gas. Barangkali sobat juga sedang membutuhkan materi tersebut. Namun untuk hari ini tim RUMUSPELAJARAN.COM akan mencoba membahas materi reaksi redoks.
Karena kami meyakini kalau sobat berkunjung ke blog ini karena sedang mencari referensi materi reaksi redoks. Mungkin juga sobat membutuhkan informasi lainnya seputar reaksi redoks seperti konsep reaksi redoks, cara menentukan reaksi redoks dan lain sebagainya.
Tidak perlu Panjang lebar, langsung saja mari kita lanjutkan ke pembahasan pengertian reaksi redoks, penyetaraan reaksi redoks, fungsi reaksi redoks dan contoh soal reaksi redoks berikut ini.
Pengertian Reaksi Redoks
Reaksi Redoks adalah istilah yang menjelaskan perubahan pada bilangan oksidasi atau keadaan oksidasi atom-atom dalam sebuah reaksi kimia.
Hal ini bisa berupa proses redoks yang sederhana seperti oksidasi karbon yang menghasilkan karbon dioksida, atau reduksi karbon oleh hidrogen yang menghasilkan metana (CH4), ataupun juga bisa berupa proses yang kompleks seperti oksidasi gula pada tubuh manusia melalui rentetan transfer elektron yang rumit.
Ada dua konsep reaksi redoks, yaitu reduksi dan oksidasi. Berikut adalah penjelasannya:
- Oksidasi adalah menjelaskan pelepasan elektron oleh sebuah molekul, atom, atau ion
- Reduksi adalah menjelaskan penambahan elektron oleh sebuah molekul, atom, atau ion.
Meskipun cukup tepat untuk digunakan dalam berbagai tujuan, penjelasan di atas tidaklah persis benar. Sejatinya oksidasi dan reduksi merujuk pada perubahan bilangan oksidasi pasalnya transfer elektron yang sebenarnya tidak akan selalu terjadi.
Sehingga oksidasi lebih baik didefinisikan sebagai peningkatan bilangan oksidasi, dan reduksi sebagai penurunan bilangan oksidasi. Dalam praktiknya, transfer elektron akan selalu mengubah bilangan oksidasi, namun terdapat banyak reaksi yang diklasifikasikan sebagai “redoks” walaupun tidak ada transfer elektron dalam reaksi tersebut (misalnya yang melibatkan ikatan kovalen).
Reaksi metatesis adalah nama dari reaksi non-redoks yang tidak melibatkan perubahan muatan formal (formal charge).
PELAJARI MATERI FISIKA: PENGERTIAN GELOMBANG ELEKTROMAGNETIK DAN DEFINISI BESARAN
Penyetaraan Reaksi Redoks
Untuk menyetarakan reaksi redoks ada dua metode, yaitu metode perubahan bilangan oksidasi (biloks) dan metode setengah reaksi (metode ion elektron), berikut penjelasannya.
1. Metode Perubahan Biloks
Berikut adalah cara penyetaraan reaksi redoks dengan metode perubahan bilangan oksidasi (biloks):
- Menentukan suatu bilangan oksidasi (biloks) masing-masing pada substansi dan mengidentifikasi atom atau ion mana yang akan mengalami perubahan biloks.
![]()
- Menuliskan jumlah elektron yang akan dilepaskan pada oksidasi serta jumlah elektron yang telah diterima pada reduksi berdasarkan jumlah perubahan biloks.

- Menghitung koefisien reaksi reaktan pada bilangan bulat yang paling kecil untuk bisa menyetarakan jumlah pada elektron yang ditransfer selama oksidasi dan reduksi, selanjutnya menyetarakan koefisien reaktan dan produk.

- Menyetarakan atom O pada H2O(l), selanjutnya menyetarakan atom H pada H+(aq).
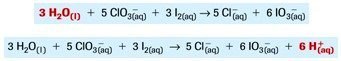
Dan berikut metode perubahan biloks untuk reaksi redoks dalam larutan suasana basa:
- Menambah atom OH−(aq) pada reaktan dan produk dengan jumlah yang sesuai dengan jumlah atom H+(aq).
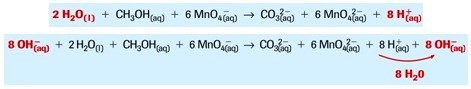
- Mengkombinasikan atom H+(aq) dan OH−(aq) dengan sisi yang mempunyai persamaan bentuk H2O(l), kemudian menghilangkan jumlah H2O(l) yang sama dengan kedua sisi tersebut.
![]()
2. Metode Setengah Reaksi / Ion Elektron
Berikut adalah cara penyetaraan reaksi redoks dengan metode ion elektron:
- Membagi persamaan reaksi ke dalam 2 setengah reaksi yaitu oksidasi dan reduksi.

- Penyetaraan atom-atom selain H dan O dengan masing-masing pada setengah reaksi.
![]()
- Menyetarakan atom O dengan H2O(l), selanjutnya menyetarakan dengan atom H pada H+(aq).
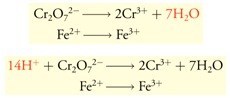
- Menyetarakan muatan pada elektron (e−).
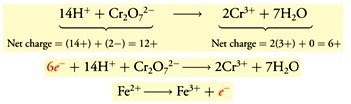
- Mengalikan koefisien dengan masing-masing setengah-reaksi pada bilangan bulat yang terjadi, agar jumlah e−yang dilepas pada setengah-reaksi oksidasi sama dengan jumlah e− yang diterima pada setengah-reaksi reduksi.
![]()
- Penggabungan kedua setengah-reaksi yang sudah setara menjadi satu persamaan reaksi, lalu menghilangkan jumlah spesi-spesi yang sama pada kedua sisi.
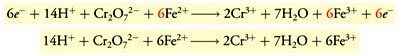
Dan berikut meode setengan reaksi untuk reaksi redoks dalam larutan suasana basa:
- Menambahkan OH−(aq) dengan reaktan dan produk dengan jumlah yang sesuai jumlah H+(aq).
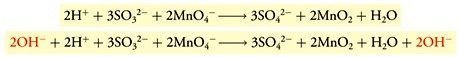
- Mengkombinasi H+(aq) dan OH−(aq) dengan sisi yang sama mempunyai bentuk H2O(l), dan menghilangkan jumlah H2O(l) yang sama pada kedua sisi.
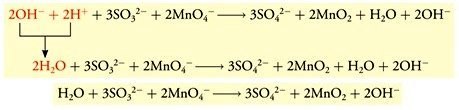
PELAJARI JUGA MATERI FISIKA: RANGKAIAN LISTRIK DINAMIS DAN JUGA CONTOH LISTRIK STATIS
Fungsi Reaksi Redoks
Reaksi redoks juga berfungsi untuk kehidupan sehari-hari, Adapun fungsinya antara lain sebagai berikut:
- Reaksi pada fotosintetis.
- Oksidasi makanan pada sel.
- Pemahaman fenomena korosi logam dan cara mencegahnya.
- Pembuatan asam sulfat pada keperluan suatu industri.
- Mengolah biji-biji logam pada industri pertambangan.
- Metabolisme pada organ-organ tubuh manusia menggunakan reaksi redoks.
- Penggunaan lumpur aktif kedalam pengolahan limbah.
- Mur dan baut diberikan lapisan zinc, pada lapisan itu ada proses oksidasi logam zinc dan reduksi di bagian kation.
- Alat-alat dapur yang berbahan stainless steel, tidak akan berkarat karena pada permukaannya telah dilapisi oksida dengan proses oksidasi yang berlanjut.
Contoh Soal Reaksi Redoks
Untuk menguji apakah sobat sudah paham dengan penjelasan tentang reaksi redoks, silahkan sobat mencoba untuk menjawab pertanyaan dibawah ini.
MnO4−(aq) + C2O42−(aq) → MnO2(s) + CO32−(aq)
Setarakan persamaan reaksi redoks dalam larutan suasana basa di atas dengan menggunakan metode:
(a) perubahan biloks.
(b) setengah reaksi.
Demikianlah pembahasan materi mengenai pengertian reaksi redoks, penyetaraan, fungsi dan contoh soal reaksi redoks. Semoga bermanfaat bagi sobat yang sedang mencari referensi tentang materi pelajaran reaksi reduksi dan oksidasi (redoks). Jangan lupa pelajari juga tujuan destilasi dan juga contoh unsur, senyawa dan campuran yang telah kami sajikan di halaman lainnya.

























